INTRODUCCIÓN A LOS MATERIALES METÁLICOS
Comenzamos querido bloggers con una nueva entrada de nuestro blog de clase, que este caso tratara sobre una breve introducción a los materiales metálicos, espero que os guste............let´s go........
Comenzamos pues explicando lo que es un enlace químico:

Enlace significa unión, un enlace químico es la unión de dos o más átomos con un solo fin, alcanzar la estabilidad, tratar de parecerse al gas noble más cercano. Para la mayoría de los elementos se trata de completar ocho electrones en su último nivel.
Las fuerzas atractivas que mantienen juntos los elementos que conforman un compuesto, se explican por la interacción de los electrones que ocupan los orbitales más exteriores de ellos (electrones de valencia).
En la mayoría de los átomos, con excepción de los gases nobles (muy estables, con su última capa o nivel de energía completo con sus ocho electrones), las fuerzas atractivas son superiores a las repulsivas y los átomos se acercan formando un enlace.
En resumen son las fuerzas de atracción que mantienen unidos entre sí a los átomos o iones para formar moléculas o cristales. Los tipos de enlaces presentes en una sustancia, son responsables en gran medida de sus propiedades físicas y químicas. Los enlaces son responsables además, de la atracción que ejerce una sustancia sobre otra.
En resumen son las fuerzas de atracción que mantienen unidos entre sí a los átomos o iones para formar moléculas o cristales. Los tipos de enlaces presentes en una sustancia, son responsables en gran medida de sus propiedades físicas y químicas. Los enlaces son responsables además, de la atracción que ejerce una sustancia sobre otra.
Así, podemos considerar al enlace químico como la fuerza que mantiene unidos a dos o más átomos dentro de una molécula.
Todos los enlaces químicos resultan de la atracción simultánea de uno o más electrones por más de un núcleo.
Hay varios tipos de enlaces químicos pero nos centraremos en los 3 mas comunes que son el enlace iónico, el enlace covalente, el enlace metálico que seré en los que mas me centre a la hora de explicarlos sobretodo en el metálico puesto que es en el que se centra esta entrada del blog, aparte de estos tambien existen los enlaces flexionados, los aromáticos, los enlaces de 1 y 3 electrones......
Enlace iónico:
Este enlace se produce cuando átomos de elementos metálicos
(especialmente los situados más a la izquierda en la tabla periódica -períodos
1, 2 y 3) se encuentran con átomos no metálicos (los elementos situados a la
derecha en la tabla periódica -especialmente los períodos 16 y 17).
En este caso los átomos del metal ceden electrones a los
átomos del no metal, transformándose en iones positivos y negativos,
respectivamente. Al formarse iones de carga opuesta éstos se atraen por fuerzas
eléctricas intensas, quedando fuertemente unidos y dando lugar a un compuesto
iónico. Estas fuerzas eléctricas las llamamos enlaces iónicos.

Enlace covalente:
Los enlaces covalentes son las fuerzas que mantienen unidos
entre sí los átomos no metálicos (los elementos situados a la derecha en la
tabla periódica -C, O, F, Cl, ...).
Estos átomos tienen muchos electrones en su nivel más
externo (electrones de valencia) y tienen tendencia a ganar electrones más que
a cederlos, para adquirir la estabilidad de la estructura electrónica de gas
noble. Por tanto, los átomos no metálicos no pueden cederse electrones entre sí
para formar iones de signo opuesto.
En este caso el enlace se forma al compartir un par de
electrones entre los dos átomos, uno procedente de cada átomo. El par de
electrones compartido es común a los dos átomos y los mantiene unidos, de
manera que ambos adquieren la estructura electrónica de gas noble. Se forman
así habitualmente moléculas: pequeños grupos de átomos unidos entre sí por
enlaces covalentes.

Enlace metálico:
Para explicar las propiedades características de los metales
(su alta conductividad eléctrica y térmica, ductilidad y maleabilidad, ...) se
ha elaborado un modelo de enlace metálico conocido como modelo de la nube o del
mar de electrones:
Los átomos de los metales tienen pocos electrones en su
última capa, por lo general 1, 2 ó 3. Éstos átomos pierden fácilmente esos
electrones (electrones de valencia) y se convierten en iones positivos, por
ejemplo Na+, Cu2+, Mg2+. Los iones positivos resultantes se ordenan en el
espacio formando la red metálica. Los electrones de valencia desprendidos de
los átomos forman una nube de electrones que puede desplazarse a través de toda
la red. De este modo todo el conjunto de los iones positivos del metal queda
unido mediante la nube de electrones con carga negativa que los envuelve.
Ahora pondré un pequeño resumen en modo de comparación entre uno y otro
Compuestos iónicos
Son sólidos con puntos de fusión altos (> 400 ºC ).
Muchos son solubles en disolventes polares como el agua.
La mayoría son insolubles en disolventes no polares.
Los compuestos fundidos conducen bien la electricidad porque
contienen partículas móviles con carga (iones).
Las soluciones acuosas conducen bien la electricidad porque
contienen partículas móviles con carga (iones)
compuestos covalentes
Son gases, líquidos o sólidos, con puntos de fusión bajos, por lo general < 300 ºC .
Muchos de ellos son insolubles en disolventes polares.
La mayoría es soluble en disolventes no polares.
Los compuestos líquidos o fundidos no conducen la electricidad.
Las soluciones acuosas suelen ser malas conductoras de la electricidad porque no contienen partículas con carga.
El enlace metálico es muy distinto a los dos tipos de
enlaces que hemos visto hasta ahora: el enlace covalente y el enlace iónico. En
los compuestos metálicos los átomos están muy próximos los unos a los otros y
forman estructuras compactas. Además, presentan unas características propias,
entre las que destaca la elevada conductividad eléctrica. Esta propiedad, la de
la conductividad, requiere para ser explicada que los electrones implicados en
el enlace metálico tengan libertad y facilidad de movimiento. Es por este
motivo que, para que los metales tengan electrones móviles, requieren 2
características a nivel atómico: la primera, una energía de ionización baja
(recordemos que la energía de ionización es la energía necesaria para arrancar
un electrón de la capa de valencia) y la segunda, que posean orbitales de
valencia vacíos y accesibles que permitan a los electrones moverse con
facilidad.
Cualquier teoría sobre el enlace metálico debe dar
explicación a esta libertad de movimiento electrónico y a las restantes
propiedades de los metales. Estas son dos: la llamada teoría del gas
electrónico o del mar de electrones y la teoría de bandas.
La teoría de bandas está basada en la mecánica cuántica y procede de la teoría de los orbitales moleculares (TOM). En esta teoría, se considera el enlace metálico como un caso extremo del enlace covalente, en el que los electrones de valencia son compartidos de forma conjunta y simultánea por todos los cationes. Desaparecen los orbitales atómicos y se forman orbitales moleculares con energías muy parecidas, tan próximas entre ellas que todos en conjunto ocupan lo que se franja de denomina una “banda de energía”.
Aunque los electrones van llenando los orbitales moleculares en orden creciente de energía, estas son tan próximas que pueden ocupar cualquier posición dentro de la banda.
La banda ocupada por los orbitales moleculares con los electrones de valencia se llama banda de valencia, mientras que la banda formada por los orbitales moleculares vacíos se llama banda de conducción. A veces, ambas bandas se solapan energéticamente hablando.Este modelo explica bastante bien el comportamiento eléctrico no solo de las sustancias conductoras sino también de las semiconductoras y las aislantes.
En los metales, sustancias conductoras, la banda de valencia se solapa energéticamente con la banda de conducción que está vacía, disponiendo de orbitales moleculares vacíos que pueden ocupar con un mínimo aporte de energía, es decir, que los electrones están casi libres pudiendo conducir la corriente eléctrica.
En los semiconductores y en los aislantes, la banda de valencia no se solapa con la de conducción. Hay una zona intermedia llamada banda prohibida.En los semiconductores, como el Silicio o el Germanio, la anchura de la banda prohibida no es muy grande y los electrones con suficiente energía cinética pueden pasar a la banda de conducción, por esa razón, los semiconductores conducen la electricidad mejor en caliente. Sin embargo, en los aislantes, la banda prohibida es tan ancha que ningún electrón puede saltarla. La banda de conducción está siempre vacía.
Teoría del gas electrónico:
Fue la primera en desarrollarse. La teoría más sencilla del
enlace metálico fue introducida por Drude a principios de siglo y recibió el
nombre de teoría del electrón libre o del mar de electrones. Dice que los
átomos poseen una electronegatividad baja, los electrones no están atraídos por
el núcleo. Su potencial de ionización es bajo, por tanto sus electrones
externos no están atraídos por el núcleo.
Así, la estructura sería una serie de restos positivos
unidos por los electrones externos de cada átomo que no pertenecen al átomos,
sino al conjunto.
ENLACE METÁLICO TEORÍA BANDAS VÍDEO
Una vez tenemos claros los distintos tipos de enlace y explicado a fondo o con mas detalle por decirlo de alguna forma, me centrare ahora en las características de los materiales metálicos que es lo mas importante para saber como se comportan:






El elemento químico hierro forma parte de la corteza terrestre
en un porcentaje del 5 %. Nunca se presenta en estado puro, sino combinado en
forma de óxidos, hidróxidos, carbonatos y sulfuros. Los principales minerales
de los que forma parte son la magnetita, la hematites roja, la siderita, la
limonita y la pirita.

Como se dijo anteriormente las características del acero varían mucho en función de su composición pero en términos generales se puede decir que el acero se aproxima a lo siguiente:
características enlace metálico:
1. Suelen ser sólidos a temperatura ambiente, excepto el mercurio, y sus puntos de fusión y ebullición varían notablemente.
2. Las conductividades térmicas y eléctricas son muy elevadas (esto se explica por la enorme movilidad de sus electrones de valencia).
3. Presentan brillo metálico, por lo que son menos electronegativos.
4. Son dúctiles y maleables (la enorme movilidad de los electrones de valencia hace que los cationes metálicos puedan moverse sin producir una situación distinta, es decir, una rotura).
5. Pueden emitir electrones cuando reciben energía en forma de calor. 6. Tienden a perder electrones de sus últimas capas cuando reciben cuantos de luz (fotones), fenómeno conocido como efecto fotoeléctrico.
Los metales tienen una serie de características que los
diferencian de los demás materiales, los no metales. Además de que todos, a
excepción del mercurio, son sólidos, la más característica de las propiedades
de los metales es su brillo especial, que curiosamente se llama brillo
metálico. El brillo es la capacidad de un material para reflejar, absorber o
reflectar la luz. Los metales, una vez pulidos, reflejan la mayor parte de la
luz que les llega.
Otra característica que cumplen la casi totalidad de los
metales es ser buenos conductores eléctricos y mostrar carga eléctrica positiva
en los procesos de electrólisis. La estructura electrónica de los átomos
metálicos se caracteriza por la existencia de pocos electrones en su capa
externa, por lo que se requiere escasa energía para que los pierdan y adopten
la estructura estable en forma de cationes. Además, en una masa metálica, los
electrones de valencia fluctúan de uno a otro átomo formando la denominada
“nube electrónica”, de algún modo compartida por todos los átomos del metal.
Así muchos son empleados para hacer cables, etc... Además también son buenos
conductores del calor.
Los metales son materiales, en general, bastante densos,
insolubles en agua y en muchos disolventes, y opacos con un espesor adecuado.
En cuanto a las propiedades metálicas podemos decir que los
metales presentan resistencia a la tracción, es decir, que pueden soportar
grandes cargas, que se calcula poniendo el material en una cubeta imprimiéndole
una fuerza que se aumenta progresivamente y dividiendo la carga máxima de
fuerza que se la ha aplicado a la probeta por la sección transversal de la
misma.
Los metales son poco duros, así una de las funciones más
importantes de las aleaciones es mejorar esta propiedad. La dureza se delimita
dejando caer contra una superficie pulida de un metal una bola de acero
especial y muy duro (método Brinell) o un diamante piramidal (método Vickers).
Una vez hecho esto podemos medir la dureza del metal de dos maneras: por la
relación entre la carga en kilogramos y la huella dejada en el metal en
milímetros cuadrados, estaremos hablando de dureza de retroceso, o bien
teniendo en cuenta la altura que adquiere la bola en el rebote, cuanto más blando
sea el material, menor altura alcanzará ya que la energía del impacto ha sido
absorbida en casi su entera totalidad por la deformación del metal, y se
llamará dureza a la penetración.
Los metales son muy dúctiles, es decir, que se pueden
estirar en forma de hilos; y bastante maleables, podemos estirarlos en láminas
sin romperlos. Una de las malas propiedades de los metales es su baja
resistencia a la fatiga, o la situación en la que se encuentran algunos metales
tras ser expuestos a ciclos de carga de una intensidad menor al crítico de
rotura del material.
Entre las características en el carácter químico no se puede
establecer una relación común a todos los metales ya que, por ejemplo, en el
caso de la oxidación, nos encontramos con una diferencia ostensible tanto en
tiempo como en la energía liberada. Existen metales inoxidables como el oro y
los hay que tardan menos de un día en oxidar su capa exterior a un milímetro de
profundidad como el hierro, el cobalto y el bario.
Todo metal tiene una estructura macroscópica imperceptible al ojo humano a simple vista por lo que para su estudio y posterior uso en construcciones necesitamos saber sus estructura para evitar posteriores accidentes, por lo tanto lo primero que hay que explicar es la metalográfica que no es mas que la disciplina que estudia microscópicamente las
características estructurales de un metal o de una aleación.
En el siguiente apartado hablaremos de la estructura cristalina de los metales de una manera un poco general
En los metales los átomos se ordenan formando redes
tridimensionales, ocupando posiciones de equilibrio en los vértices de determinadas
formas geométricas. A la agrupación elemental de átomos se la conoce como celda
unitaria, y a la agrupación de éstas formaciones se las denomina redes
cristalinas y se definen en cristalografía por tres vectores concurrentes en un
origen y los tres ángulos que forman éstos entre ellos.
Los metales de uso industrial más frecuente cristalizan en
tres redes:
- Red cúbica centrada (c.c.): hierro alfa, cromo, titanio,
molibdeno, etc.
- Red cúbica de caras centradas (c.c.c.): hierro gamma,
cobre, aluminio, oro, plomo, níquel, etc.
- Red hexagonal compacta (e.c.): magnesio, cinc, cadmio,
etc.
También se emplea la abreviatura inglesa para designar las
redes cristalinas:
-Red cúbica centrada BCC.
-Red cúbica de caras centradas FCC.
-Red hexagonal compacta HCP.
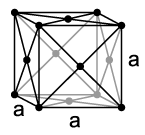
RED CÚBICA CENTRADA: los átomos se hallan dispuestos en los
vértices y en el centro del cubo.

RED CÚBICA CENTRADA EN LAS CARAS: los átomos están
dispuestos en los vértices y en los
átomos de las caras del cubo.

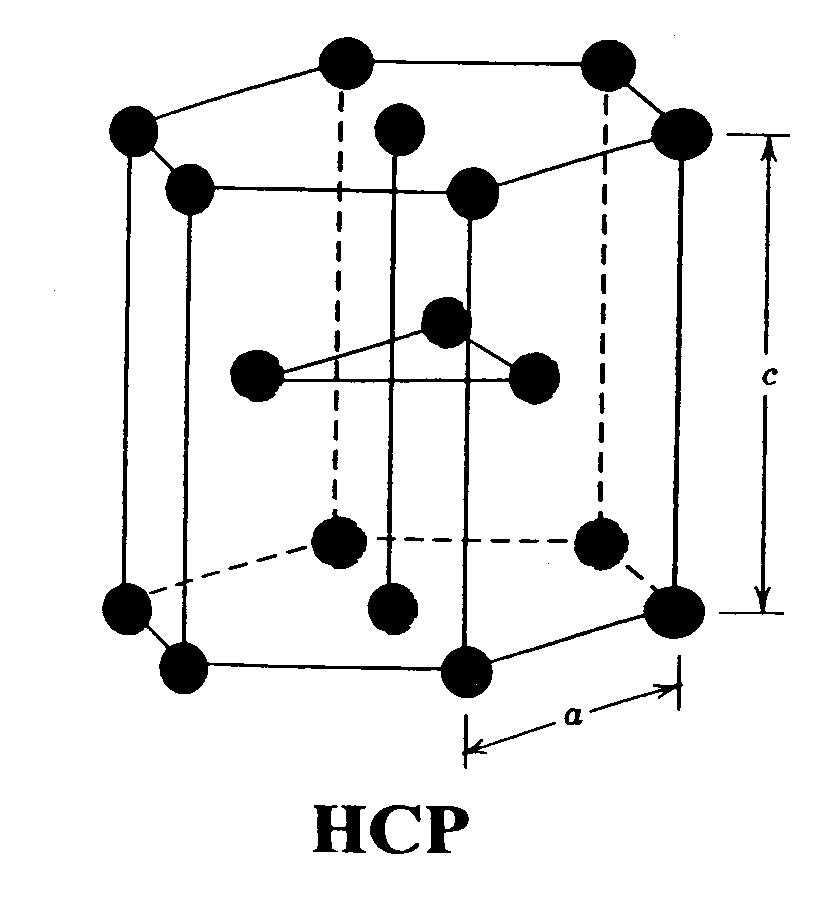
RED HEXAGONAL COMPACTA: En esta red, los átomos se sitúan en
los vértices de un prisma hexagonal, además uno en cada base y tres en un plano
horizontal en el centro del prisma.

Sin duda, el microscopio es la herramienta más importante del metalurgista tanto desde el punto de vista científico como desde el técnico. Es posible determinar el tamaño de grano, forma y distribución de varias fases e inclusiones que tienen gran efecto sobre las propiedades mecánicas del metal. La microestructura revelará el tratamiento mecánico y térmico del metal y, bajo un conjunto de condiciones dadas, podrá predecirse su comportamiento esperado.
La experiencia ha demostrado que el éxito en el estudio microscópico depende en mucho del cuidado que se tenga para preparar la muestra. El microscopio más costoso no revelará la estructura de una muestra que haya sido preparada en forma deficiente. El procedimiento que se sigue en la preparación de una muestra es comparativamente sencillo y requiere de una técnica desarrollada sólo después de práctica constante. El último objetivo es obtener una superficie plana, sin rayaduras, semejante a un espejo. Las etapas necesarias para preparar adecuadamente una muestra metalográfíca.
TAMAÑO GRANO
El tamaño de grano tiene un notable efecto en las propiedades mecánicas del metal. Los efectos del crecimiento de grano provocados por el tratamiento térmico son fácilmente predecibles. La temperatura, los elementos aleantes y el tiempo de impregnación térmica afectan el tamaño del grano.
En metales, por lo general, es preferible un tamaño de grano pequeño que uno grande. Los metales de grano pequeño tienen mayor resistencia a la tracción, mayor dureza y se distorsionan menos durante el temple, así como también son menos susceptibles al agrietamiento. El grano fino es mejor para herramientas y dados. Sin embargo, en los aceros el grano grueso incrementa la endurecibilidad, la cual es deseable a menudo para la carburización y también para el acero que se someterá a largos procesos de trabajo en frío.
Todos los metales experimentan crecimiento de grano a altas temperaturas. Sin embargo, existen algunos aceros que pueden alcanzar temperaturas relativamente altas (alrededor de 1800 F o 982 C) con muy poco crecimiento de grano, pero conforme aumenta la temperatura, existe un rápido crecimiento de grano. Estos aceros se conocen como aceros de grano fino. En un mismo acero puede producirse una gama amplia de tamaños de grano.

Una vez tenemos un idea mas o menos clara de los metales y de su estructura interna hablaremos un poco mas de los materiales metálicos y para ello haremos una clasificación según su densidad e importancia industrial, lo primero que hay que explicar es el significado de densidad que no es mas que la cantidad de masa de una sustancia en un determinado volumen
TABLA DE DENSIDADES DE LOS METALES MÁS CORRIENTES A 15 ºC
METAL
|
DENSIDAD/ g ml-1
|
METAL
|
DENSIDAD/ g ml-1
|
| ALUMINIO | 2,70 | COBRE | 8,93 |
| CINC | 7,10 | CROMO | 7,10 |
ESTAÑO
| 7,29 | HIERRO | 7,87 |
| NÍQUEL | 8,90 | PLATA | 10,50 |
| PLOMO | 11,30 | MERCURIO | 13,50 |
| ORO | 19,30 | PLATINO | 21,50 |
Los metales tienen una gran importancia para nuestra
sociedad desarrollada de hoy en día. Sin los metales y los recursos minerales
seguramente no podríamos tener muchos de los “lujos” de los que disponemos:
Muchos de los importantes inventos que han permitido un
avance en el desarrollo de la humanidad no se habrían podido llevar a cabo.
Por poner varios ejemplos citamos por ejemplo los medios de
transporte modernos (como el avión, los buques, los coches, trenes...), ya que
son necesarios en su fabricación.
La electricidad, porque los metales conductores son los que
permiten el paso de la misma en los cables, sin ella no habría luz, ni agua(ya
que la fuerza del agua en las tuberías la logra gracias a la electricidad) ni
nada que fuera relacionada con ella.
Las viviendas; es cierto que podrían haber viviendas de
hormigón con vigas de madera, pero también lo es que con vigas de metales
serían más resistentes y pueden tener bastantes pisos de altitud.
Los medios de comunicación, porque todos los medios de
comunicación necesitan metales en sus industrias, ya que:
Sin los metales no habría ordenadores que ordenaran a las
máquinas el trabajo que deben hacer (ya se sabe que las máquinas pueden hacer
el mismo trabajo que los hombres pero muchísimo más rápido.
Por todos estos motivos decimos que los metales y los
recursos minerales son imprescindibles.
La mayoría de los metales no se emplea en estado puro sino en aleaciones; es decir, formando una mezcla homogénea con otros metales o no metales, obtenida a partir de la fusión de ambos.
De entre todos los metales sobresalen el hierro y sus aleaciones porque suponen el 90 % de la producción mundial de metales. Esto es consecuencia de las ventajas que tiene el hierro para la industria: es abundante, es barato y mejora sus propiedades al formar aleaciones. Por esta razón clasificaremos los metales en:
* Metales férricos: corresponde al grupo de aleaciones cuyo componente principal es el hierro.
* Metales no férricos: son los metales puros y las aleaciones de metales que no tienen hierro en su composición
De entre todos los metales sobresalen el hierro y sus aleaciones porque suponen el 90 % de la producción mundial de metales. Esto es consecuencia de las ventajas que tiene el hierro para la industria: es abundante, es barato y mejora sus propiedades al formar aleaciones. Por esta razón clasificaremos los metales en:
* Metales férricos: corresponde al grupo de aleaciones cuyo componente principal es el hierro.
* Metales no férricos: son los metales puros y las aleaciones de metales que no tienen hierro en su composición
Debido al gran numero de metales que hay mencionare y explicare dos de cada tipo para no alargar demasiado esta entrada
FÉRRICOS
el HIERRO (Fe)
Es el metal más usado, con el 95% en peso de la producción mundial de metal. El hierro puro (pureza a partir de 99,5%) no tiene demasiadas aplicaciones, salvo excepciones para utilizar su potencial magnético. El hierro tiene su gran aplicación para formar los productos siderúrgicos, utilizando este como elemento matriz para alojar otros elementos aleantes tanto metálicos como no metálicos, que confieren distintas propiedades al material. Se considera que una aleación de hierro es acero si contiene menos de un 2% de carbono; si el porcentaje es mayor, recibe el nombre de fundición. El acero es indispensable debido a su bajo precio y dureza, especialmente en automóviles, barcos y componentes estructurales de edificios. Los aceros bajos en carbono se empelan para piezas de ingeniería que necesitan una alta resistencia mecánica y al desgaste; los aceros altos en carbono se emplean principalmente en las herramientas. Las fundiciones dependiendo de sus características se emplean en motores, válvulas, engranajes, etc. L os óxidos de hierro por su parte se emplean para pinturas; la magnetita y el oxido de hierro III se emplean en aplicaciones magnéticas y el Fe (OH)3 se emplea en radioquímica para concentrar los actínidos mediante Co-precipitación.

El MAGNESIO (Mg) Los óxidos de magnesio se utilizan como material refractario en hornos para la producción de hierro y acero, cemento, etc. Su uso principal es como elemento de aleación de aluminio en envases de bebidas, en componentes de los automóviles, el las llantas. Además el hidróxido (leche de magnesia), el cloruro, el sulfato (sales Epsom) y el citrato se emplean en la medicina. El polvo de carbonato de magnesio es utilizado por los gimnastas y levantadores de peso para mejorar el agarre a los objetos. Es prácticamente imprescindible en la escalada de dificultad para secar mano y dedos (el sudor) del escalador y mejorar la adherencia a la roca. Otros usos incluyen flashes fotográficos, pirotecnia y bombas incendiarias, entre otros usos.

NO FÉRRICOS
El COBRE (Cu) Debido a su extraordinaria conductividad, el uso más extendido del cobre se da en la industria eléctrica. Su ductilidad permite transformarlo en cables de cualquier diámetro, desde 0,025 Mm. en adelante. Puede usarse tanto en cables y líneas de alta tensión exteriores como en el cableado eléctrico en interiores, cables de lámparas y maquinaria eléctrica en general: generadores, motores, reguladores, equipos de señalización, aparatos electromagnéticos y sistemas de comunicaciones.
A lo largo de la historia, el cobre se ha utilizado para acuñar monedas y confeccionar útiles de cocina, tinajas y objetos ornamentales. En un tiempo era frecuente reforzar con cobre la quilla de los barcos de madera. Algunas soluciones de cobre tienen la propiedad de disolver la celulosa, por lo que se usan grandes cantidades de cobre en la fabricación de rayón. También se emplea el cobre en muchos pigmentos, en insecticidas como el verde de Schweinfurt, o en fungicidas como la mezcla de Burdeos, aunque para estos fines está siendo sustituido ampliamente por productos orgánicos sintéticos.

El ZINC (Zn) El metal se usa principalmente como capa protectora o galvanizador para el hierro y el acero, y como componente de distintas aleaciones, especialmente del latón. También se utiliza en las placas de las pilas (baterías) eléctricas secas, y en las fundiciones a troquel. El óxido de cinc, conocido como cinc blanco, se usa como pigmento en pintura. También se utiliza como rellenados en llantas de goma y como pomada antiséptica en medicina. El cloruro de cinc se usa para preservar la madera y como fluido soldador. El sulfuro de cinc es útil en aplicaciones relacionadas con la electroluminiscencia, la fotoconductividad, la semiconductividad y otros usos electrónicos; se utiliza en los tubos de las pantallas de televisión y en los recubrimientos fluorescentes.

Poniendo punto y a parte a esta clasificación me centrare en explicar un poco mas a fondo el ACERO así que intentare hablar sobre su descubrimiento, procedencia mineralógica del hierro, importancia histórica, características, propiedades más significativas, estructuras cristalográficas y sobre los colores del acero en función de la temperatura
El elemento químico hierro forma parte de la corteza terrestre
en un porcentaje del 5 %. Nunca se presenta en estado puro, sino combinado en
forma de óxidos, hidróxidos, carbonatos y sulfuros. Los principales minerales
de los que forma parte son la magnetita, la hematites roja, la siderita, la
limonita y la pirita.
El proceso de fabricación industrial del acero se remonta a
1740, en que Huntsman lo obtuvo por fusión de hierro y carbón vegetal en un
crisol.
Posteriormente, Cort ideó un método de afino en un horno de
reverbero, denominado pudelado, que redujo los costes y aumentó la producción.
El impulso definitivo para la producción de acero en gran
escala fue dado casi simultáneamente con dos sistemas distintos: el método del
convertidor Bessemer, que permite obtener directamente acero mediante afino de
la fundición gracias a la acción de un chorro de aire que se introduce en el
horno, y el método de Martin y Siemens, en el cual se funde una mezcla de
chatarra de hierro con fundición y mineral en un horno de arco eléctrico.
En la época contemporánea, el acero se obtiene del hierro
líquido, y presenta una gran resistencia a la deformación y a la corrosión.
El carbono que contiene (entre 0,8 y 1,6 %) está en forma de
carburo de hierro (cementita).
Los diferentes metales que se le pueden añadir en pequeña
proporción mejoran sus propiedades (dureza, resistencia) y constituyen los
llamados aceros especiales, como los aceros al cromo-níquel, los aceros al
manganeso y los aceros rápidos.
El acero al carbono sólo contiene hierro y carbono y, según
la proporción existente de este último, se clasifica en dulce (menos del 0,3
%), duro (0,5 %) o extraduro (más del 0,65 %).
El acero inoxidable contiene un 18 % de cromo y un 8 % de
níquel (acero 18/8) y, como su nombre indica, presenta una resistencia óptima a
la corrosión.
El acero se obtiene a partir del hierro y su mezcla con carbono por lo tanto explicare como dije antes la procendencia minerologica del hierro:
OBTENCIÓN DE HIERRO: EL HORNO ALTO
El dispositivo habitual para obtener hierro a partir de sus
minerales es el denominado horno alto. Se trata de una instalación compleja cuyo
principal objetivo es la obtención de arrabio, es decir, hierro con un contenido
en carbono que oscila entre el 2,6 % Y el 6,7 % Y
que contiene otras cantidades de silicio, manganeso, azufre
y fósforo que oscilan en torno al
0,05 %.
Una vez obtenido el arrabio o el hierro esponja es necesario refinar al hierro para que se transforme hierro o acero comercial.
Una vez obtenido el arrabio o el hierro esponja es necesario refinar al hierro para que se transforme hierro o acero comercial.

Pero centremos en el acero que es el metal del que estamos hablando ahora no se tiene a ciencia cierta un indicio de cual fue la fecha exacta de la elaboración de los primeros aceros, pero se identifican productos elaborados de acero, en el año 3000 A.C., sin embargo los primeros aceros producidos con características similares de calidad ( cantidad suficiente) al acero actual fueron obtenidos por Sir Henry Bessemer en 1856 con la ayuda de un proceso por el diseñado utilizando fósforo y azufre, sin embargo debido a la necesaria presencia de estos elementos, ha caido en desuso, siendo sustituido por el sistema inventador por Sir William Siemens en 1857 el cual descarburiza la aleación de acero con la ayuda de óxido de hierro.
Actualmente los procesos han ido mejorando el acero en especial el usado mediante la reducción con oxigeno inventado en Austria en 1948 y el colada contian que es el que permite la formación de perfiles mediante la dosificación del material fundido en un molde enfriado por agua que genera un elemento constante en su sección el mismo que es afinado en sus dimensiones con rodillos

El uso intensivo que tiene y ha tenido el acero a lo largo de su HISTORIA para la construcción de estructuras metálicas ha conocido grandes éxitos y rotundos fracasos que al menos han permitido el avance de la ciencia de materiales. Así, la Torre Eiffel, construida en París en 1889 es hoy día uno de los monumentos más visitados del mundo mientras el 7 de noviembre de 1940 el mundo asistió al colapso del puente Tacoma Narrows al entrar en resonancia con el viento. Ya durante los primeros años de la Revolución Industrial se produjeron roturas prematuras de ejes de ferrocarril que llevaron a William Rankine a postular la fatiga de materiales y durante la Segunda Guerra Mundial se produjeron algunos hundimientos imprevistos de los cargueros estadounidenses Liberty al fragilizarse el acero por el mero descenso de la temperatura, problema inicialmente achacado a las soldaduras
Lo que propiamente se puede llamar tecnología del acero tuvo sus inicios en los albores del siglo XIX, y alcanzó su consolidación alrededor de 1861, con la invención de hornos que permitieron su producción masiva y la sucesión vertiginosa y abundante de nuevas aleaciones a base de este material.

El uso intensivo que tiene y ha tenido el acero a lo largo de su HISTORIA para la construcción de estructuras metálicas ha conocido grandes éxitos y rotundos fracasos que al menos han permitido el avance de la ciencia de materiales. Así, la Torre Eiffel, construida en París en 1889 es hoy día uno de los monumentos más visitados del mundo mientras el 7 de noviembre de 1940 el mundo asistió al colapso del puente Tacoma Narrows al entrar en resonancia con el viento. Ya durante los primeros años de la Revolución Industrial se produjeron roturas prematuras de ejes de ferrocarril que llevaron a William Rankine a postular la fatiga de materiales y durante la Segunda Guerra Mundial se produjeron algunos hundimientos imprevistos de los cargueros estadounidenses Liberty al fragilizarse el acero por el mero descenso de la temperatura, problema inicialmente achacado a las soldaduras
Lo que propiamente se puede llamar tecnología del acero tuvo sus inicios en los albores del siglo XIX, y alcanzó su consolidación alrededor de 1861, con la invención de hornos que permitieron su producción masiva y la sucesión vertiginosa y abundante de nuevas aleaciones a base de este material.
La primera de ellas fue la obtenida a nivel experimental por
Faraday, al fundir una mezcla de acero y níquel y una mezcla de acero y cromo,
lo que ocurrió alrededor de 1819. Posteriormente se obtuvo el acero al
tungsteno en 1858, y diez años más tarde, el acero al manganeso, que ha
resultado ser una aleación con propiedades idóneas para la fabricación de
herramienta. Ya en 1877, se obtiene el acero al cromo.
Cada una de estas aleaciones posee características que
permiten su utilización de manera específica, y podríamos escribir muchísimo
acerca del desarrollo que ha tenido este material, al punto de que aún en la
actualidad, a más de un siglo de su surgimiento, se continúa trabajando
intensamente en las aleaciones del acero. Existen programas de investigación
tendientes a resolver el problema de la creación de aceros especiales, ya sea
que se busque obtener mayor resistencia mecánica de éstos, mayor dureza o
flexibilidad, o se busquen aleaciones que resistan temperaturas cada vez más
elevadas con objeto de obtener materiales que vengan a resolver problemas en
aeronáutica, en perforación de pozos petroleros o extracción de petróleo, o que
se trate de producir materiales más resistentes a la corrosión por salinidad o
acidez, etcétera.
Características:
Como se dijo anteriormente las características del acero varían mucho en función de su composición pero en términos generales se puede decir que el acero se aproxima a lo siguiente:
Densidad de 7850 Kg/m3
Punto de función depende de la aleación pero se puede considerar los 1500 C como un valor medio.
Punto de ebullición de 3000 C
Es dúctil (maleable) y tenaz (resistente al impacto) y por lo tanto tiene a ser fácilmente maquinable con ayuda de máquinas herramientas así como soldable.
La corrosión suele ser uno de los peores enemigos del acero ya que este se oxida fácilmente, por lo cual es recomendado protegerlo del contacto con el aire y la humedad mediante la aplicación de pinturas o tratamientos superficiales, o en su defecto se lo mezcla con cromo para evitar este efecto (acero inoxidable)
Es un buen conductor del calor y la electricidad y tiene también una interesante capacidad de dilatarse aproximadamente 1,2*10-5 y es muy similar al del hormigón por lo cual es una razón más para usarlo en la construcción
estructura cristalina del acero:
acero por debajo de los 723ºC su sistema cristalino es una red cubica centrada en las caras (fcc)
acero entre los 723ºC y los 911ºC su sistema cristalino es una red cubica centrada en el cuerpo (bcc)
acero por encima de los 911ºC sus sistema cristalino vuelve a ser una red cubica centrada en las caras (fcc)





Casi todo el Aluminio se obtiene de un mineral
denominado Bauxita que se presenta exógeno en sus yacimientos, arcilla cuyo
contenido metálico es de más del 40%. La Bauxita es una mena residual,
producida por la meteorización de las rocas ígneas en condiciones
geomorfológicas favorables

En la antigüedad se utilizaba en forma de sal doble como
tintorería y para uso medicinal (hoy en día se sigue utilizando) pero sin la
consciencia de manejar un metal.
A principios del siglo XIX, la única forma de conseguir
aislarlo era por procedimientos químicos y a un gran coste, en ínfimas
cantidades y de una pésima calidad.
No fue hasta más avanzado el siglo XIX cuando, por medio de
la electrólisis, se consiguió aislarlo en cantidades suficientes y con una
pureza aceptable.
No obstante su producción era tan costosa que se consideraba
un metal precioso.
En la exposición universal de París en 1855, se expusieron
unas barras de aluminio junto a las joyas de la corona francesa, y el mismo
emperador Napoleón se jactaba de tener una vajilla de aluminio para agasajar a
sus invitados.
La extracción de la bauxita en masa mineral del que por
medio de la electrólisis se extrae el aluminio y el desarrollo de medios de
producción eléctricos masivos hicieron, ya finalizados el siglo XIX, que el
aluminio se empezase a producir de forma masiva, abandonando la estantería de
metales raros y preciosos, y entrando en la de metales comunes.
A partir de ese momento la carrera del aluminio pasó de su
producción a la búsqueda de aplicaciones del mismo.
Fue quizás durante la II Guerra Mundial donde se tomó
conciencia de su importancia a nivel industrial, y donde se gestó el
disparadero de su uso máximo a nivel mundial.

Pero centrémonos en lo que realmente nos importa a la hora de trabajar que son las propiedades mas características :
Punto de función depende de la aleación pero se puede considerar los 1500 C como un valor medio.
Punto de ebullición de 3000 C
Es dúctil (maleable) y tenaz (resistente al impacto) y por lo tanto tiene a ser fácilmente maquinable con ayuda de máquinas herramientas así como soldable.
La corrosión suele ser uno de los peores enemigos del acero ya que este se oxida fácilmente, por lo cual es recomendado protegerlo del contacto con el aire y la humedad mediante la aplicación de pinturas o tratamientos superficiales, o en su defecto se lo mezcla con cromo para evitar este efecto (acero inoxidable)
Es un buen conductor del calor y la electricidad y tiene también una interesante capacidad de dilatarse aproximadamente 1,2*10-5 y es muy similar al del hormigón por lo cual es una razón más para usarlo en la construcción
Estructuras cristalinas
El hierro puro presenta tres estados alotrópicos a medida
que se incrementa la temperatura desde la temperatura ambiente:
Hasta los 911 °C, el
hierro ordinario, cristaliza en el sistema cúbico centrado en el cuerpo (BCC) y
recibe la denominación de hierro α o ferrita. Es un material dúctil y maleable
responsable de la buena forjabilidad de las aleaciones con bajo contenido en
carbono y es ferromagnético hasta los 768 °C (temperatura de Curie a la que
pierde dicha cualidad). La ferrita puede disolver muy pequeñas cantidades de
carbono.
Entre 911 y 1400
°C cristaliza en el sistema cúbico centrado en las caras (FCC) y recibe la
denominación de hierro γ o austenita. Dada su mayor compacidad la austenita se
deforma con mayor facilidad y es paramagnética.
estructura cristalina del acero:
acero por debajo de los 723ºC su sistema cristalino es una red cubica centrada en las caras (fcc)
acero entre los 723ºC y los 911ºC su sistema cristalino es una red cubica centrada en el cuerpo (bcc)
acero por encima de los 911ºC sus sistema cristalino vuelve a ser una red cubica centrada en las caras (fcc)

Entre 1400 y 1538 °C cristaliza de nuevo en el sistema
cúbico centrado en el cuerpo y recibe la denominación de hierro δ que es en
esencia el mismo hierro alfa pero con parámetro de red mayor por efecto de la
temperatura.
A mayor temperatura el hierro se encuentra en estado
líquido.
Si se añade carbono al hierro, sus átomos podrían situarse
simplemente en los intersticios de la red cristalina de éste último; sin
embargo en los aceros aparece combinado formando carburo de hierro (Fe3C), es
decir, un compuesto químico definido y que recibe la denominación de cementita
de modo que los aceros al carbono están constituidos realmente por ferrita y
cementita.
El diagrama de fases Fe-C muestra dos composiciones
singulares:

Un eutéctico (composición para la cual el punto de fusión es
mínimo) que se denomina ledeburita y que contiene un 4,3% de carbono (64,5 % de
cementita). La ledeburita aparece entre los constituyentes de la aleación
cuando el contenido en carbono supera el 2% (región del diagrama no mostrada) y
es la responsable de la mala forjabilidad de la aleación marcando la frontera
entre los aceros con menos del 2% de C (forjables) y las fundiciones con
porcentajes de carbono superiores (no forjables y fabricadas por moldeo). De
este modo se observa que por encima de la temperatura crítica A320 los aceros
están constituidos sólo por austenita, una solución sólida de carbono en hierro
γ y su microestructura en condiciones de enfriamiento lento dependerá por tanto
de las transformaciones que sufra ésta.

Un eutectoide en la zona de los aceros, equivalente al
eutéctico pero en estado sólido, donde la temperatura de transformación de la
austenita es mínima. El eutectoide contiene un 0,77 %C (13,5% de cementita) y
se denomina perlita. Está constituido por capas alternas de ferrita y
cementita, siendo sus propiedades mecánicas intermedias entre las de la ferrita
y la cementita.
La existencia del eutectoide permite distinguir dos tipos de
aleaciones de acero:
Aceros
hipoeutectoides (< 0,77% C). Al enfriarse por debajo de la temperatura
crítica A3 comienza a precipitar la ferrita entre los granos (cristales) de
austenita y al alcanzar la temperatura crítica A1 la austenita restante se
transforma en perlita. Se obtiene por tanto a temperatura ambiente una
estructura de cristales de perlita embebidos en una matriz de ferrita.
Aceros
hipereutectoides (>0,77% C). Al enfriarse por encima de la temperatura
crítica se precipita el carburo de hierro resultando a temperatura ambiente
cristales de perlita embebidos en una matriz de cementita.
Las texturas básicas descritas (perlíticas) son las
obtenidas enfriando lentamente aceros al carbono, sin embargo modificando las
condiciones de enfriamiento (base de los tratamientos térmicos) es posible
obtener estructuras cristalinas diferentes:

La martensita es el constituyente típico de los aceros
templados y se obtiene de forma casi instantánea al enfriar rápidamente la
austenita. Es una solución sobresaturada de carbono en hierro alfa con
tendencia, cuanto mayor es el carbono, a la sustitución de la estructura cúbica
centrada en el cuerpo por tetragonal centrada en el cuerpo. Tras la cementita
(y los carburos de otros metales) es el constituyente más duro de los aceros.
Velocidades
intermedias de enfriamiento dan lugar a la bainita, estructura similar a la
perlita formada por agujas de ferrita y cementita pero de mayor ductilidad y
resistencia que aquélla.
También se puede
obtener austenita por enfriamiento rápido de aleaciones con elementos
gammágenos (que favorecen la estabilidad del hierro γ) como el níquel y el
manganeso, tal es el caso por ejemplo de los aceros inoxidables austeníticos.
Antaño se identificaron también la sorbita y la trostita
que han resultado ser en realidad perlitas de muy pequeña distancia
interlaminar por lo que dichas denominaciones han caído en desuso.
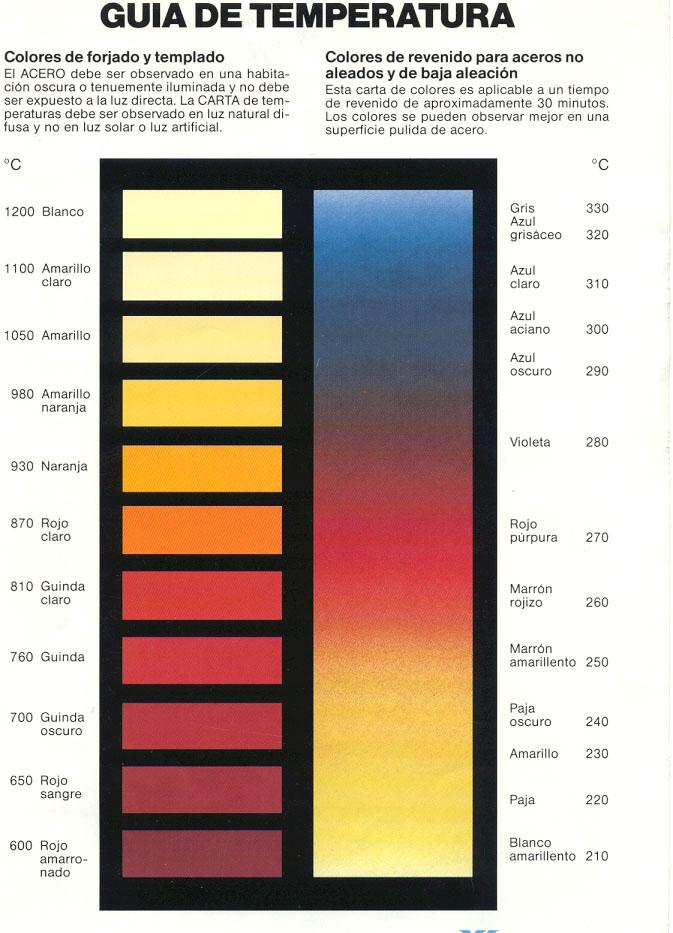
Ahora os pondré una foto que muestra una guía de como varia el color del acero según se va calentado

Una vez hemos desglosado el acero explicaremos un poco el aluminio es el segundo metal más empleado en el mundo gracias a sus
propiedas únicas: ligereza, alta resistencia, gran versatilidad, facilidad de
mecanizado, excelente resistencia a la corrosión .... Además el aluminio es
100% reciclable ilimitadamente.

Pero comencemos hablando de su descubrimiento para despues centrarnos en sus caracteristicas
El descubrimiento del aluminio como elemento químico se
atribuye al científico alemán Friedrich Wohler ( tambien descubrió el berilio), primera persona en lograr aislar el aluminio en forma
pura (Oersted lo hizo dos años antes pero en forma impura). Finalmente, Sir
Humphry Davy, quien también participó en el descubrimiento del flúor, propuso
llamar este metal como aluminio.
En estado puro, el aluminio es un metal blanco y plateado,
con varias características que lo convierten en un elemento muy útil para los
seres humanos. Es un elemento muy ligero, no es ferromagnético y tampoco genera
chispas, siendo el segundo metal mejor maleable que existe, uno de los más
abundantes en la corteza de la Tierra (8,1%) y el sexto más dúctil que se
conoce.
Algunos de los compuestos de aluminio más importantes son el
óxido de aluminio, el sulfato de aluminio y un tipo de sulfato soluble con
potasio llamado alumbre.
Si bien es uno de los elementos más abundantes en la corteza
terrestre, encontrarlo en forma libre en la naturaleza no es una posibilidad.
Se lo puede encontrar en el granito, la criolita y otros minerales comunes
similares. El óxido de alúmina sí se produce naturalmente y se lo puede
encontrar, por ejemplo, en forma de rubí, zafiro, corindón y esmeril.

No obstante, la mayor parte de aluminio que hoy tenemos
procede de una mezcla artificial de sodio, de aluminio y calcio, y de algunos
fluoruros. También puede producirse a partir de arcilla, pero el proceso no es
económicamente viable, por lo cual no es de los comunes en la actualidad.
Historicamente hablando el aluminio es un metal de aplicación muy reciente a nivel
industrial.
Gráfico de la evolución de la producción del aluminio

Actualmente es segundo metal más usado y sus aplicaciones se
han disparado a todos los ámbitos de nuestra vida, como son la alimentación,
medicina,maquinaria, construcción, defensa, energía, etc.
Posiblemente nos envuelve muchas veces sin darnos cuenta en
todo lo que nos rodea.
Pero centrémonos en lo que realmente nos importa a la hora de trabajar que son las propiedades mas características :
El aluminio es ligero, su densidad es 1/ la del acero: 2.700
kg/m3
Resistencia
Las aleaciones de aluminio más comunes tienen una resistencia que va entre 70 y 700 MPa. Las más
usadas para la extrusión abarcan un
rango de entre 150 y 300 MPa. A diferencia de la mayoría de los aceros, el
aluminio no se convierte en un metal quebradizo a bajas temperaturas. Al
contrario, su resistencia aumenta.
A altas temperaturas, la resistencia del
aluminio se reduce.
Versatilidad
La superior maleabilidad del aluminio es clave para la
extrusión. Con el metal, tanto frío como caliente, esta propiedad también es
importante para el curvado de bandas y láminas, tanto como para el curvado de
los perfiles.
Conductividad
El aluminio es un excelente conductor del calor y la
electricidad. Un conductor de aluminio pesa casi la mitad que otro de cobre con
la misma conductividad.
Reflectividad
El aluminio es un buen reflector tanto de la luz visible
como del calor irradiado.
Resistencia a la corrosión
El aluminio reacciona con el oxígeno en el aire formando un
capa excelentemente fino de óxido. Aunque es sólo su espesor es sólo la
centésima parte de un (my)m (1 (my)m es la milésima parte de un milímetro),
esta capa es densa y proporciona una excelente protección contra la corrosión.
La capa se autorepara en caso de daños
Material no magnético
El aluminio es un material no magnético.
Toxicidad Cero
Después del oxígeno y silicio, el aluminio es el
elemento más común de la corteza terrestre
Por ultimo al igual que hice con el acero hablare un poco de la estructura cristalina del aluminio:
La estructura cristalina tanto del aluminio como sus aleaciones es una estructura cristalina centrada en la cara lo que lo hace altamente estable hasta que se fusiona a los 660.32° C. Estas propiedades lo convierten en un metal fácil de cambiar su forma y soldar. El aluminio no se inflama instantáneamente por lo que tiene numerosas aplicaciones en materiales inflamables o explosivos.
Esta claro que la vida como actualmente la conocemos no podría ser posible sin los metales y mas concretamente sin el acero y el aluminio metales que están prácticamente presentes en la mayoría de objetos que usamos a diario por lo tanto su descubrimiento me atrevo a decir que fue un gran avance en la sociedad de la época.
Bueno bloggers lo que parecía un breve introducción a los metales ha sido mas larga de lo previsto inicialmente


No hay comentarios:
Publicar un comentario